Helium 4
superfluidité et troisième son
Transport de Chaleur :
Un dispositif cryogénique doit permettre de maintenir une température beaucoup plus basse que la température ambiante, dans la zone d'expérimentation thermiquement isolée de l'extérieur. Or, la chaleur peut passer d'un corps chaud (à température T 2) à un corps froid (T 1) par conduction, par convection ou encore par rayonnement. Ces trois contributions à la puissance transférée suivent des lois différentes qui peuvent s'exprimer de la manière suivante, pour une configuration semblable à celle de la figure 1:
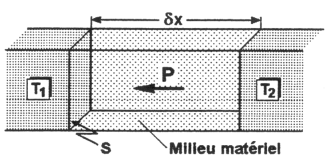
Figure 1 : transfert de puissance entre deux corps
L’hélium est un liquide (pour refroidir les supraconducteurs classiques, entre 0,2 et 4,2 K) et l'azote liquide (pour les écrans thermiques à 77 K, et pour refroidir les supraconducteurs à haute température critique). De plus, les deux isotopes de l'hélium ( 3He et 4He) sont utilisés, soit séparément soit ensemble dans les cryostats à dilution. (Voir figure 2)

Figure 2 : cryostat utilisé durant le stage
Quelques propriétés de ces éléments sont mentionnées dans le tableau suivant pour les liquides cryogénique utilisés pendant le stage :
| T Liquéfaction [K] | T Solidification [K] |
Densité |
|
| N 2 | 77.36 |
63.3 |
0.808 |
| 4 He | 4.21 |
superfluide à 2.17 K |
0.121 |
| 3 He | 3.18 |
superfluide à 2.6 mK |
0.082 |
Cryostat à Dilution :
Considérons un cryostat à dilution (Voir Figure 3). Ce dispositif va permettre d'atteindre de très basse température. Pour cela, on injecte dans la chambre de mélange des atomes de 3He. D'autre part dans le conduit qui relie la chambre de mélange et l'évaporateur, un film de superfluide va se former. Celui-ci va conduire des atomes de 4He et 3He vers l'évaporateur. Pourquoi des atomes 3He ? Car ils sont pris dans le mouvement des atomes de 4He (La zone inférieur est riche en 4He, mais cela ne veut pas dire qu'il n'y a pas de 3He.) et remonte le conduit.
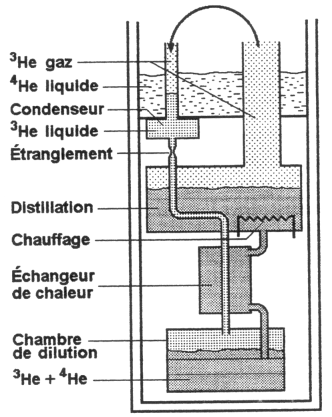
Figure 3 : Schéma du cryostat à dilution.
Mais pourquoi remonte il ? Prenons une partie du conduit (Voir Figure 20), telle que la grandeur h soit de l'ordre de 0,1mm afin de pouvoir négliger la force de Van der Waals.
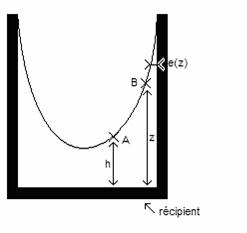
Figure 3 : Effet capillaire dans le conduit
entre chambre de mélange et évaporateur
Nous pouvons alors calculer les potentiels chimique en A et B :
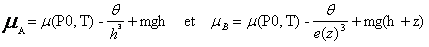
A et B étant tout les deux à l'interface liquide-gaz, ils ont le même potentielchimique, et la même pression :
PA = PB = P0.
Remarque : Origine des potentiels de pesanteur pris à la base du récipient.
Par choix de h nous pouvons négliger le terme ![]() . En égalisant
. En égalisant ![]() et
et ![]() :
:
![]()
Soit :
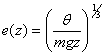
Cette relation nous permet de comprendre que l'on peut avoir des films qui montent très haut.
Exemple : Dans le cas du verre on trouve pour z = 1m une épaisseur de e = 18al, Ce que l'on perd en potentiel de pesanteur, on le gagne en force de Van der Waals. Une fois arrivé dans l'évaporateur, les atomes de 3He s'évaporent, et ceux en plus grande quantité que ceux de 4He (Pression de vapeur de 3He plus importante que celle de 4He).
Une question se pose alors, pourquoi pomper des atomes de 3He que l'on a introduit juste avant ?
Les atomes 3He nous pas la même entropie dans la zone N que dans la zone S :
![]()
Dans la zone riche en 4He, les atomes de 3He on plus de configuration d'arrangement possible. Quand 3He passe de la zone N à S il faut lui fournir de l'entropie et donc de la chaleur :
![]()
Cette quantité de chaleur va être prise au système grâce au pompage qui force les atomes à passer d'une zone à l'autre. On baisse ainsi la température du système.