Introduction: Les effets
Réduction de la tension superficielle:
Comme nous l'avons déjà évoqué, quand des molécules de tensioactifs sont placées dans l'eau, elles remontent à la surface.
Pourquoi celà a-t-il un effet sur la tension superficielle?
Prenons l'exemple de l'interface eau/air, la tension superficielle de l'eau est la force de traction appliquée par les molécules intérieures sur les molécules de surface.
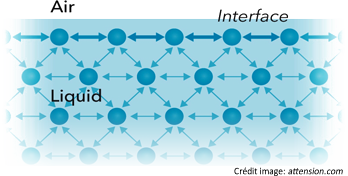
Figure 3: force inter-moléculaire
Lorsque des tensioactifs sont introduits, on observe une augmentation d'entropie. Alors qu'ils se stabilisent à la surface, ils dérangent la structure de l'eau entraînant une augmentation de l'énergie libre du système.

Une énergie libre de surface plus grande implique une surface agrandie, la tension de surface a été diminuée.
Il est possible d'observer ce phénomène lorsqu'une goutte d'eau est placée sur une surface plane.
En temps normal, la tension superficielle tendra à donner à la goutte une forme sphérique:
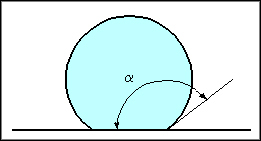
Figure 4: goutte avant ajout de tensioactif
En présence de tensioactifs la goutte va s'étaler:
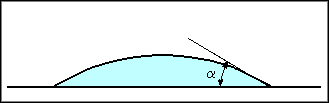
Figure 5: goutte après ajout de tensioactif
C'est cette propriété qui est très intéressante pour la peinture et tous les types d'encre.
Effet dégraissant:
C'est ici que l'ont retrouve le terme d'
agrégat de tensioactifs. Un par un, les tensioactifs n'ont aucune efficacité dans les produits nettoyants, ils ne deviennent utiles que lorsqu'ils se regroupent sous forme de
micelles.
Une micelle est donc un regroupement de molécules de tensioactifs, elles se forment à partir d'une certaine concentration (voir partie
CMC pour plus d'informations).
Il existe plusieurs types de micelles, nous évoquerons ici la micelle sphérique directe avec les parties hydrophobes à l'intérieur de la structure (à opposer aux micelles inverses orientées dans l'autre sens):
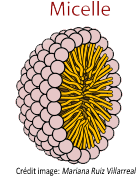
Figure 6: micelle sphérique directe
C'est sous cette forme que l'agrégat peut piéger le corps gras en son centre et jouer le rôle d'agent dégraissant.
Effet émulsifiant:
Prenons l'exemple bien connu d'un mélange d'eau et d'huile. Même une fois mélangées, les molécules d'huile, hydrophobes, se regroupent entre elles pour former au final deux couches bien distinctes.
L'interêt d'un émulsifiant est de regrouper ces deux milieux au mieux possible, et c'est ce que va permettre le tensioactif. Les molécules amphiphiles vont naturellement se regrouper à l'interface et former une couche protéctrice entre l'eau et l'huile. Ainsi protégées, les gouttelettes d'huile acceptent de rester au sein du liquide sans se regrouper : on obtient une émulsion stable. On peut aussi parler de micelles dans ce cas.

Figure 7: émulsion eau/huile
Effet moussant:
Le principe reste le même que l'effet émulsifiant mais avec une interface eau/air. La mousse est une dispersion de bulles de gaz dans un milieu liquide ou solide. Dans une solution aqueuse, ces petites bulles sont créées et stabilisées par la structure amphiphile du tensioactif. La différence est que nous n'avons pas de micelles mais une double couche de tensioactifs (une sur la surface extérieure et une autre sur la surface intérieure).
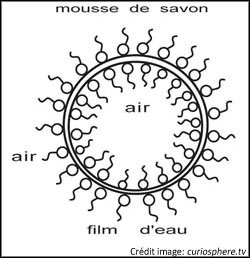
Figure 8: bulle de savon


 Une énergie libre de surface plus grande implique une surface agrandie, la tension de surface a été diminuée.
Une énergie libre de surface plus grande implique une surface agrandie, la tension de surface a été diminuée.






