-
DU GRAPHITE AU GRAPHENE
LE GRAPHITE
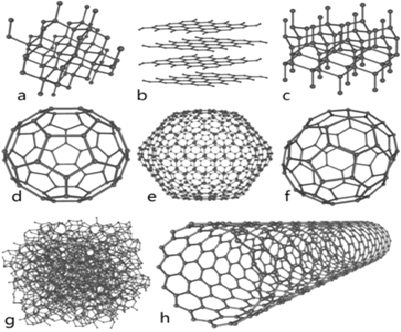
Le graphite est une espèce minérale qui est, avec le diamant, la lonsdaléite et la chaoite, l’un des allotropes naturels du carbone.
C’est un élément natif qui se trouve surtout dans les sédiments de métamorphisme régional mais qui, selon les roches, peut se former aussi à partir du charbon organique, du magma ou par réduction des carbonates. On peut donc en trouver de grandes quantités à faible coût.
LE GRAPHENE

La structure du graphite est constituée de feuillets hexagonaux non compacts, nommés graphènes, séparés d’environ 0,336 nm [1] le long de la direction de leurs normales. Dans chaque feuillet, chaque atome de carbone est fortement lié par des liaisons covalentes de type sigma pour ses 3 électrons sp2, et des liaisons covalentes de type π pour son autre électron p. Ces liaisons π sont des liaisons conjuguées avec les trois atomes voisins, les électrons y sont très mobiles ce qui explique la grande conductivité électrique et thermique ainsi que la couleur noire du graphite. Entre les feuillets, les liaisons sont faibles de type Liaison de van der Waals, ce qui explique le clivage et la faible dureté.
Il a été isolé en 2004 par Andre Geim, du département de physique de l’université de Manchester. Pour cette découverte, Andre Geim a reçu, avec Konstantin Novoselov, le prix Nobel de physique en 2010.
LES PROPRIETES DU GRAPHENE

Trois propriétés exceptionnelles du graphène l’imposent comme un des plus intéressants sujets d’étude du moment.
La première est une structure périodique parfaite. L’ordre cristallin parfait semble dériver des liens interatomiques forts, qui donnent une substance plus résistante que le diamant, tout en étant très flexible. La qualité de ce réseau donne aussi une conductivité électrique remarquable pour le graphène, car ses électrons peuvent circuler sans être ralentis par les défauts de réseau.
La deuxième caractéristique exceptionnelle est que les électrons de conduction bougent beaucoup plus vite, comme s’ils avaient une masse beaucoup plus petite que les électrons qui circulent dans des métaux et semi-conducteurs normaux. Voici la structure de bande pour le moins étrange du graphène :
Ces « porteurs de charge » dans le graphène sont des particules gouvernées par des lois de la mécanique quantique relativiste. Actuellement, on trouve ce type de phénomène seulement dans le graphène. Grâce à ce matériau, les phénomènes d’électrodynamique quantique ou QEM déjà observables dans la cosmologie et dans les expériences de particules à haute énergie sont maintenant étudiables dans les laboratoires de nanotechnologie.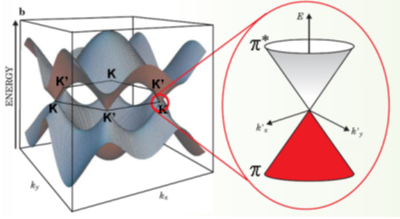
La troisième propriété est que le graphène est stable aux échelles nanométriques, ouvrant un chemin vers des dispositifs électroniques ultimes.
Ce matériau possède aussi le record de conduction thermique : jusqu’à 5 300 W·m-1·K-1. De plus, il possède une excellente résistance mécanique de l’ordre de la quarantaine de GPa par mètre carré, ainsi qu’une résistance à la rupture 200 fois supérieure à celle de l'acier et alors qu’il est 6 fois plus léger [2].
Cependant, les effets intéressants du graphène au niveau électronique n’apparaissent que dans le domaine quantique, c’est-à-dire quand l’épaisseur des couches de graphène est proche du libre parcours moyen de l’électron. En pratique, au-delà d’une dizaine de couches de graphène, les effets électroniques perdent nettement en qualité.
Alors avec toutes ces propriétés fabuleuses dont dispose le graphène, pourquoi n’est-il pas omniprésent dans les domaines de l’électronique et de la construction ? C’est parce qu’il a un coût de fabrication encore trop élevé.
LES METHODES DE PRODUCTION
Le graphène peut être produit de plusieurs manières :
- exfoliation avec du ruban adhésif, consistant à arracher couche après couche directement sur un morceau de graphite jusqu’à ce qu'il ne reste plus qu'une couche de graphène sur le substrat. Cette méthode est particulièrement longue et laborieuse.
- par épitaxie, il s'agit du chauffage d’un cristal de carbure de silicium, afin de libérer les atomes de silicium. Ne restant plus que ceux de carbone, ils se recombineront en graphène. Mais cette technique est limitée au support de SiC.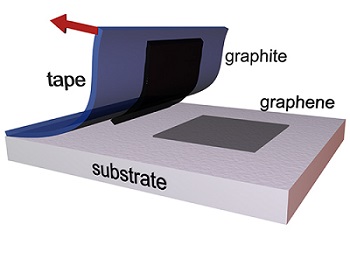
- par voie chimique, le principe consiste à oxyder du graphite dans un milieu acide (acide sulfurique) puis d'utiliser un solvant réducteur (hydrazine) pour purifier le graphène. Cette méthode n'est ni écologique, ni économique et le matériau obtenu est de mauvaise qualité. - par décomposition catalytique à haute température d'un gaz carboné sur un métal tel que du cuivre, nickel ou iridium. Cependant, le graphène risque de s'oxyder et d'avoir un grand nombre d'impureté. - exfoliation par ultrason, avec l'utilisation d'un dispersant. Actuellement, cette méthode fait l'objet de nombreux sujets d'étude afin d'évaluer son efficacité. Pour notre expérience, nous utiliserons cette méthode.Plus de détails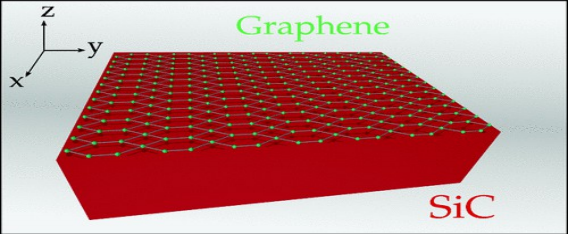
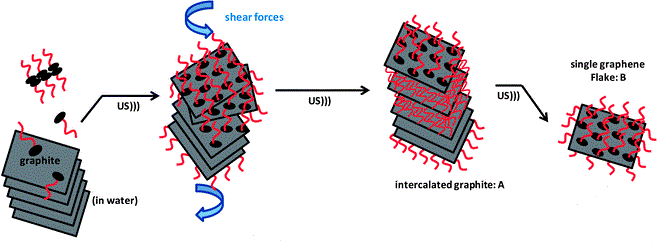
[1] A.K. Geim and K.S. Novoselov, THE RISE OF GRAPHENE, Manchester Centre for Mesoscience and Nanotechnology, University of Manchester, Oxford Road M13 9PL, United Kingdom, nature material, Vol 6, March 2007. [2] Class for Physics of the Royal Swedish Academy of Sciences, Scientific Background on the Nobel Prize in Physics 2010 GRAPHENE.