Colorants
Spectre d'absorption de l'atmosphère terrestre
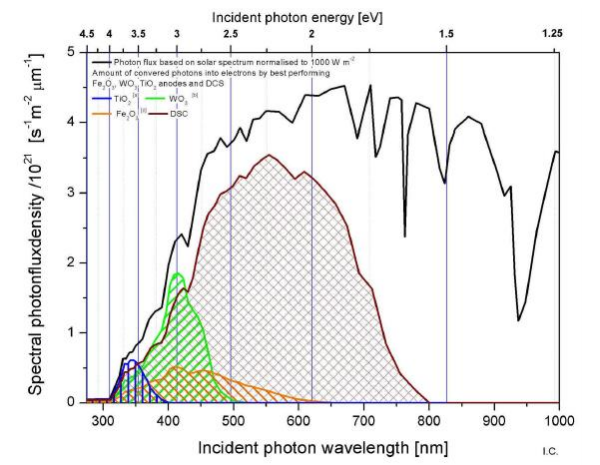
Schéma sur la fenêtre d'adsorption des différents semi-conducteurs
La capacité d’absorption de photons par les photocatalyseurs est essentiellement limitée au domaine des UV laissant alors un rendement faible (presque nul) du système dans la production d’électrons qui à son tour devient inutile en comparaison à son prix de construction.
Les colorants sont devenus une alternative incontournable pour la construction de cellules photo-catalytiques de part leur capacité à réagir avec le spectre appartenant au domaine du visible et par la forte production d’électrons interagissant, par la suite, avec le semi-conducteur.
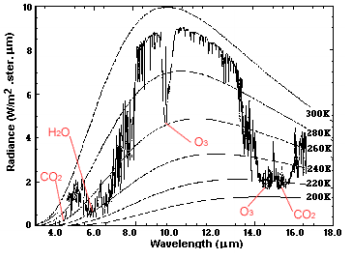
Nous pouvons remarquer que l’énergie reçue depuis le rayonnement des étoiles est principalement absorbée par l’atmosphère terrestre et affiche un pic de rayonnement dans le visible.
C’est pourquoi l’utilisation des colorants est devenue presque quasi incontournable pour espérer une augmentation rentable du taux de production d’hydrogène dans les cellules photo-catalytiques.
Les colorants ont la particularité d’être chargés négativement, en interagissant avec la lumière ces derniers vont alors pouvoir céder leurs électrons vers le semi-conducteur.
Mécanisme théorique
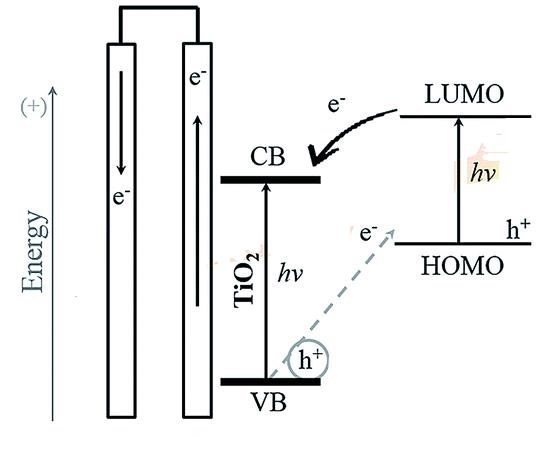
Dans un premier temps, la lumière est absorbée par un colorant sensible aux stimuli photoniques.
Le colorant va alors passer d'un état stable que l'on appellera S à un état excité S*.
Le temps de vie moyen de l'état excité est de l'ordre de la nano-seconde avant de retomber dans un état plus stable en émettant un électron.
Le champ électrique interne des nanoparticules provoque l'extraction de l'électron du colorant devenu oxydé (S+) vers la bande de conduction du semi-conducteur (cf Notre rapport).
Pour que le transfert de l'électron se le plus efficace avec le TiO2, il faut que le LUMO (bande de valence du colorant) soit d'une énergie de 0.3 eV au dessus de l'énergie de la bande de valence du semi-conducteur afin d'éviter la recombinaison de l'électron avec la bande de valence du semi-conducteur.
Le temps moyen de transfert de l'électron du LUMO à la bande de valence du semi-conducteur s'opère en un temps de l'ordre de la femto-seconde (10-15 s). Les temps de transmission jouent un rôle majeur dans la rentabilité du système car plus l'électron parcourra une distance importante entre deux éléments et plus l'électron aura des chances d'être aléatoirement capté par un quelconque atome, ou bien d'être recombiné baissant alors le nombre d'électron transmis pour la scission de l'eau.
Adsorption du colorant
Le pH est le paramètre principal rendant compte de la dégradation du colorant. Il faut aussi considérer que le pH du colorant soit supérieur à 3 pour qu'il adhère à la surface du semi-conducteur (qui lui doit être d'environ 6).
Il influence aussi l'adsorption du colorant sur le semi-conducteur :
Le taux de colorant adsorbé est obtenu par l'équation suivante :
Qads = (C0-Ce) / R
C0 : concentration du colorant à l'état initial t = 0 (mmol/L)
Ce : concentration du colorant à l'équilibre (mmol/L)
R : Masse de la poudre par unité de volume de solution (g/L)
Nous sommes ainsi en mesure de déterminer l'évolution de l'état du colorant fixé.
Rendement d'adsorption
On calcule le rendement de production du colorant par la formule suivante :
η = 100(C0-Ct) / C0
C0 : concentration du colorant à l’état initial t = 0 (mmol/L)
Ct : concentration du colorant à l’équilibre au temps t (mmol/L)
Évidemment, plus le rendement sera grand et plus nous pourrons considérer notre cellule performante.
Choix du colorant
Les colorants utilisés sont des complexes du Ruthénium de structure moléculaire proche de la chlorophylle.
Le colorant le plus utilisé, N-3 est un quadri-acide de pKa voisin de 3.8 et est représenté par la molécule :
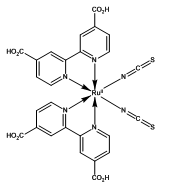
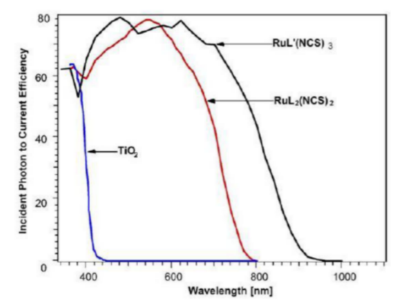
La molécule peut être considérée chargée négativement au dessus de pH 3. Le spectre d’absorption du colorant couvre tout le spectre visible du rayonnement du Soleil.
Le pic d’absorption maximum du colorant N-3 est situé vers 0.6 μm soit au maximum d’énergie solaire fournie par le Soleil.