
Construction
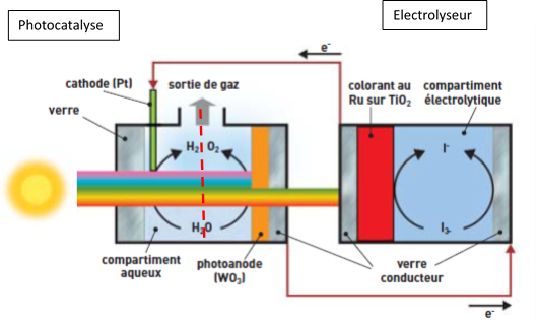
Dans cette partie nous expliquerons comment construire une cellule photo électrochimique (schéma ci-dessous)
Afin de fabriquer notre cellule, nous avons besoin du TiO2. (schéma ci-dessous)

Cependant, afin de le fabriquer, nous possédons du Ti(OPr)4.
Dans un premier temps, nous mélangeons du Ti(OPr)4 avec de l'éthanol afin de dissoudre la solution.
Ensuite, nous mettons le tout dans un mélange d'éthanol, d'eau et de HCl.
Le HCl va permettre de fournir des charges sur des grains de TiO2.
On obtient donc la réaction :
Ti(OPr)4 + 2H2O → TiO2 + 4 HOPr
Ensuite on regarde avec un spectromètre corrélation de photons.

Ce spectromètre mesure la vitesse de déplacement des particules à partir du décalage de fréquences (effet Doppler). Ensuite, on en déduit le coefficient de diffusion et on obtient le diamètre moyen des particules qui vaut 3,4 nm ce qui correspond effectivement aux bonnes dimensions.
Dépôts de TiO2 sur le verre:
- sol colloïdal.
- dipcoating→ sol/gel→ 300μm de suspension de TiO2 et après séchage 0.14μm de TiO2.
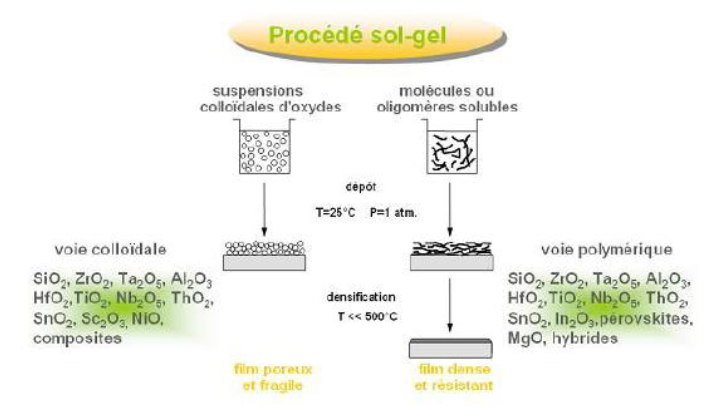
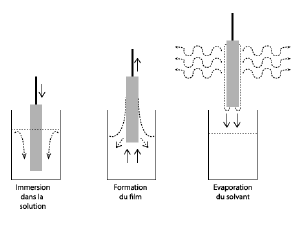
- calcination 400°C→ Cristallisation de TiO2 en anatase.
- adsorption colorant sur la surface de TiO2(pH = 4)
On remplit l'espace entre l'anode et la cathode avec l'électrolyte KI+I2+H2O (0,15Mol de I- et 0,03Mol de I3-).
3I → I3- + 2e-
Dans les deux demi-piles nous utiliserons un électrolyte à base de iodure de lithium.
(1) Premiérement nous utiliserons une demi-pile produisant le courant, elle permet l’électrolyse de l’eau, c’est cette derniére qui va produire l’électron.
(2) La seconde partie de la pile utilise le courant créé par les électrons de l’électrolyse afin d’y produire le dihydrog&ène. C’est dans cette pile que la scission photo-catalytique s’opére.
(3) La dernière partie de notre systéme va nous permettre de faire les mesures nécessaires à la détermination de la quantité d’hydrogène produit. L’acide nitrique joue ici le rôle de l’électrolyte.
Dans les deux demi-piles nous utiliserons un électrolyte à base de iodure de lithium.



(1) (2) (3)
La plus grande difficulté du montage repose sur le fait que l’étanchéité de notre cellule est assez compliquée à obtenir. Si le silicone que nous posons sur les plaques ne séche pas proprement, un ou plusieurs trous se formeront laissant ainsi notre cellule perméable et présentera des fuites où l’électrolyte pourra s’échapper.
Le nombre de réaction diminuera entraînant un déficit au niveau de la production d’hydrogène et donc du rendement.